Exercício de Química (Questões UFRGS 2020) com Gabarito QUÍMICA UFRGS 2020 - QUESTÃO 01 O sal de cozinha (cloreto de sódio) tem solubilida...
Exercício de Química (Questões UFRGS 2020) com Gabarito
QUÍMICA
UFRGS 2020 - QUESTÃO 01
O sal de cozinha (cloreto de sódio) tem solubilidade de 35,6 g em 100 mL de água em temperatura próxima a 0 °C. Ao juntar, em um copo, 200 mL de água a 0,1 °C, três cubos de gelo e 80 g de cloreto de sódio, o número de componentes e fases presentes no sistema, imediatamente após a mistura, será
(A) um componente e uma fase.
(B) dois componentes e duas fases.
(C) dois componentes e três fases.
(D) três componentes e duas fases.
(E) três componentes e quatro fases.
GABARITO. (C) dois componentes e três fases.
UFRGS 2020 - QUESTÃO 02
Os compostos abaixo apresentam a seguinte ordem decrescente de pressão de vapor a 15 °C:
éter dimetílico >> etanol > água.
Considere as afirmações abaixo que explicam esse efeito.
I - Deve-se à maior massa molar das substâncias menos voláteis.
II - Deve-se à presença de ligações de hidrogênio em maior proporção na água do que no etanol e ausentes no éter dimetílico.
III- Deve-se à elevada polaridade do éter.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas III.
(D) Apenas I e II.
(E) I , II e III.
GABARITO. (B) Apenas II.
UFRGS 2020 - QUESTÃO 03
Em 2019, o mundo celebra o Ano Internacional da Tabela Periódica dos Elementos Químicos, em reconhecimento a sua importância para o desenvolvimento da ciência moderna.
Considere os elementos X, Y e Z da tabela periódica, levando em conta as seguintes afirmações.
1 - X tem 3 elétrons na última camada.
2 - Y tem tendência a formar quatro ligações covalentes.
3 - Z necessita receber dois elétrons para adquirir a configuração de um gás nobre.
4 - Z tem raio atômico semelhante a Y.
Os elementos X, Y e Z são, respectivamente,
(A) Al – Si – Se.
(B) B – Ge – O.
(C) P – C – Te.
(D) Ga – Ge – As.
(E) In – Ba – I.
GABARITO. (A) Al – Si – Se.
UFRGS 2020 - QUESTÃO 04
O Brasil concentra 98% das reservas conhecidas de nióbio no mundo. O nióbio é muito utilizado na produção de aços especiais, que apresentam alta resistência mecânica e são usados na fabricação de dutos para óleo e gás, automóveis, navios, pontes e viadutos.
Considere as afirmações abaixo, sobre esse elemento químico.
I - Está localizado no Grupo 10 e no quarto período da tabela periódica.
II - Apresenta, em um de seus isótopos, 41 prótons e 52 nêutrons no núcleo atômico.
III- Pode ser classificado como um lantanídeo.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas III.
(D) Apenas I e II.
(E) I, II e III.
GABARITO. (B) Apenas II.
UFRGS 2020 - QUESTÃO 05
Considere a tira abaixo.
Adaptado de: <www.reddit.com>. Acesso em: 05 ago. 2019.
O conceito químico, associado a essa tira, pode ser interpretado como
(A) substâncias apolares são menos densas que a água.
(B) substâncias polares são geralmente solúveis em água.
(C) substâncias polares são mais densas que substâncias apolares.
(D) substâncias apolares são mais solúveis em água que polares.
(E) substâncias polares e apolares são miscíveis entre si.
GABARITO. (B) substâncias polares são geralmente solúveis em água.
UFRGS 2020 - QUESTÃO 06
Considere as afirmações abaixo, sobre o óxido de cálcio, CaO.
I - É um sólido iônico.
II - É bastante reativo frente à água.
III- Possui características metálicas.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas III.
(D) Apenas I e II.
(E) I, II e III.
GABARITO. (D) Apenas I e II.
UFRGS 2020 - QUESTÃO 07
Nos aterros sanitários, o processo de biodegradação da matéria orgânica ocorre geralmente em condições anaeróbicas (em ausência de oxigênio ou de ar), produzindo gases causadores do efeito estufa, metano e gás carbônico, conforme mostrado na equação abaixo, exemplificada para a glicose.
C6H12O6(s) → 3 CH4(g) + 3 CO2(g)
O volume de gases do efeito estufa, gerado pela decomposição anaeróbica de 0,9 kg de glicose nas CNTP (0 ºC e 1 atm), será de aproximadamente
(A) 22,4 L.
(B) 67,2 L.
(C) 125,4 L.
(D) 336,0 L.
(E) 672,0 L.
GABARITO. (E) 672,0 L.
UFRGS 2020 - QUESTÃO 08
O ácido cítrico, presente em quase todos os seres vivos, é um ácido fraco, encontrado em grande quantidade nas chamadas frutas cítricas.
Sabe-se que sua massa molar é 192 g mol⁻¹ e que a sua composição percentual em massa é de 37,5% de carbono, 58,3% de oxigênio e o restante de hidrogênio. Sua fórmula molecular é, portanto,
(A) C5H5O7.
(B) C5H6O7.
(C) C6H8O7.
(D) C6H9O8.
(E) C7H12O6.
GABARITO. (C) C6H8O7.
UFRGS 2020 - QUESTÃO 09
Mariscos possuem uma concha feita de carbonato de cálcio, a qual se forma quando os íons cálcio, secretados a partir das células do marisco, encontram a água do mar, rica em dióxido de carbono dissolvido.
Considere as afirmações sobre esse processo.
I - Uma das reações que ocorre é Ca²⁺ (aq) + CO3²⁻(aq) → CaCO3 (s).
II - A reação envolvendo os ions cálcio na formação da concha é uma reação do tipo ácido-base.
III- O produto formado é classificado como um óxido básico.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas III.
(D) Apenas I e II.
(E) I, II e III.
GABARITO. (A) Apenas I.
UFRGS 2020 - QUESTÃO 10
Descobertas por Gustav Rose, em 1839, as perovskitas representam uma classe de materiais com características únicas que hoje estão revelando inúmeras e versáteis aplicações em uma ampla gama de dispositivos tecnológicos.
Um tipo de perovskita muito utilizado em células solares é a baseada em haletos orgânico-inorgânicos, cuja fórmula geral é ABX3, em que A e B são cátions e X é um íon haleto.
O cátion A é orgânico, maior e mais eletropositivo que o cátion B, que é tipicamente um íon metálico bivalente.
Um exemplo desse tipo de material é
(A) CaTiO3.
(B) (CH3NH3)PbI3.
(C) (CH3NH3)FeO3.
(D) (CH3COO)SnBr3.
(E) CsPbCl3.
GABARITO. (B) (CH3NH3)PbI3.
UFRGS 2020 - QUESTÃO 11
Teoricamente, prevê-se que um ciclo com dezoito átomos de carbono seria o menor anel de carbono possível de existir.
Depois de inúmeras tentativas e fracassos, pesquisadores da Universidade de Oxford e da IBM Research conseguiram pela primeira vez sintetizar uma molécula de carbono em forma de anel com dezoito átomos de carbono, o ciclo[18]carbono (estrutura mostrada abaixo).
A descoberta, publicada na revista Science em agosto de 2019, abre novas perspectivas de aplicações em eletrônica e nanodispositivos.
Assinale a alternativa correta em relação ao ciclo[18]carbono.
(A) O ciclo[18]carbono constitui uma nova forma alotrópica do carbono.
(B) O ciclo[18]carbono é classificado como um alceno.
(C) A combustão completa de um mol de ciclo[18]carbono leva à formação da mesma quantidade de CO2 e H2O que a combustão completa de três moles de benzeno.
(D) Todos os carbonos apresentam geometria trigonal plana.
(E) A estrutura das ligações entre carbonos é semelhante à do diamante.
GABARITO. (A) O ciclo[18]carbono constitui uma nova forma alotrópica do carbono.
UFRGS 2020 - QUESTÃO 12
Recentemente, estudantes brasileiros foram premiados pela NASA (Agência Espacial Americana) pela invenção de um chiclete de pimenta, o “Chiliclete”, que auxilia os astronautas a recuperarem o paladar e o olfato. A capsaicina, molécula representada abaixo, é o componente ativo das pimentas.
A cadeia carbônica desse composto pode ser classificada como
(A) alifática, ramificada e homogênea.
(B) aromática, ramificada e homogênea.
(C) alicíclica, linear e insaturada.
(D) mista, insaturada e heterogênea.
(E) acíclica, linear e heterogênea.
GABARITO. (D) mista, insaturada e heterogênea.
UFRGS 2020 - QUESTÃO 13
Na coluna da direita, são apresentados compostos de origem natural (fontes renováveis); na da esquerda, o principal componente desses compostos.
Associe adequadamente a coluna da direita à da esquerda.
(1) Glicídios
(2) Proteínas
(3) Lipídios
( ) Melaço de cana
( ) Cera de abelha
( ) Amido de milho
( ) Clara de ovo
( ) Banha de porco
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
(A) 1 – 3 – 1 – 2 – 3.
(B) 1 – 3 – 3 – 2 – 3.
(C) 2 – 3 – 1 – 3 – 1.
(D) 2 – 1 – 1 – 2 – 3.
(E) 3 – 1 – 2 – 3 – 1.
GABARITO. (A) 1 – 3 – 1 – 2 – 3.
UFRGS 2020 - QUESTÃO 14
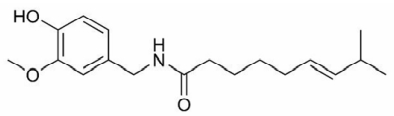
O óleo de rícino ou óleo de mamona é extraído das sementes da planta Ricinus communis e é constituído por, aproximadamente, 90% de triglicerídeos do ácido ricinoleico, cuja fórmula é representada na molécula abaixo.
Sobre essa molécula, é correto afirmar que
(A) é totalmente solúvel em meio aquoso.
(B) possui somente carbonos secundários.
(C) é o ácido 12-hidróxi-9-trans-octadecenoico, de acordo com a nomenclatura da IUPAC.
(D) possui fórmula molecular C18H34O3.
(E) apresenta isomeria ótica.
GABARITO. (E) apresenta isomeria ótica.
UFRGS 2020 - QUESTÃO 15
O estireno, composto utilizado para a produção de poli(estireno), pode ser sintetizado industrialmente através da rota sintética apresentada abaixo.
Considere as afirmações abaixo, sobre essa rota sintética.
I - A reação A é uma reação de substituição no anel aromático.
II - A reação B é uma reação de hidrogenação com catálise heterogênea.
III- O composto AlCl3 é um ácido de Lewis.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas I e III.
(D) Apenas II e III.
(E) I, II e III.
GABARITO. (C) Apenas I e III.
UFRGS 2020 - QUESTÃO 16
Na reação de cloração do 2-metilbutano em presença de luz ultravioleta, há formação de produtos monossubstituídos e HCl. O número de produto(s) monossubstituído(s) diferente(s) que podem ser formados é igual a
(A) 1.
(B) 2.
(C) 3.
(D) 4.
(E) 5.
GABARITO. (D) 4.
UFRGS 2020 - QUESTÃO 17
A dessalinização da água do mar é um processo que transforma água do mar em água potável e garante o abastecimento de milhões de pessoas no mundo. Abaixo são descritas algumas técnicas empregadas nesse processo.
1 - Aquecimento da água do mar, seguido de evaporação e condensação do vapor d´água.
2 - Resfriamento da água do mar até formação de gelo, composto essencialmente de água pura.
3 - Passagem da água do mar por uma membrana semipermeável, através da aplicação de uma pressão elevada.
As propriedades coligativas, envolvidas nas técnicas descritas nos itens 1, 2 e 3, podem ser classificadas, respectivamente, como
(A) ebulioscopia, crioscopia e osmose reversa.
(B) destilação, cristalização e filtração a vácuo.
(C) destilação, congelamento e filtração a vácuo.
(D) ebulioscopia, tonoscopia e osmose reversa.
(E) tonoscopia, crioscopia e osmose.
GABARITO. (A) ebulioscopia, crioscopia e osmose reversa.
UFRGS 2020 - QUESTÃO 18
Uma suspensão de sulfato de bário pode ser usada como agente de contraste em exames de raios-X. O sulfato de bário é um sal pouco solúvel, com constante do produto de solubilidade 1,1 × 10⁻¹⁰.
Em relação a uma solução aquosa saturada desse sal, contendo uma certa quantidade de sal sólido, não dissolvido, são feitas as seguintes afirmações.
I - A adição de nitrato de bário diminui a quantidade de sólido não dissolvido.
II - A adição de sulfato de sódio aumenta a quantidade de sólido não dissolvido.
III- Uma reação reversível, na qual a dissolução do sal é exatamente contrabalançada pela sua precipitação, é estabelecida nessa situação.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas I e III.
(D) Apenas II e III.
(E) I, II e III.
GABARITO. (D) Apenas II e III.
UFRGS 2020 - QUESTÃO 19
Uma solução é preparada misturando-se 40,00 mL de NaOH de concentração 0,30 mol L⁻¹ e 60,00 mL de KOH 0,20 mol L⁻¹.
As concentrações molares de íons Na⁺, K⁺ e OH⁻ na solução resultante serão, em mol L⁻¹, respectivamente,
(A) 0,012; 0,012 e 0,024.
(B) 0,04; 0,06 e 0,10.
(C) 0,12; 0,12 e 0,12.
(D) 0,12; 0,12 e 0,24.
(E) 0,30; 0,20 e 0,50.
GABARITO. (D) 0,12; 0,12 e 0,24.
UFRGS 2020 - QUESTÃO 20
A reação de formação do etanol é definida abaixo.
2 C (s) + 3 H2 (g) + ½ O2 (g) → C2H5OH (l)
Embora essa reação, tal como está escrita, não possa ser realizada em laboratório, pode-se calcular seu efeito térmico, mediante uma combinação adequada de outras reações.
Usando as reações abaixo,
C (s) + O2 (g) → CO2 (g)
∆f H° = -394 kJ mol⁻¹
H2 (g) + ½ O2 (g) → 2O (l)
∆f H° = -286 kJ mol⁻¹
C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (l)
∆f H° = -1368 kJ mol⁻¹
a entalpia da reação de formação do etanol, em kJ mol⁻¹, é
(A) – 2048.
(B) – 1368.
(C) – 278.
(D) + 394.
(E) + 2048.
GABARITO. (C) – 278.
UFRGS 2020 - QUESTÃO 21
Em altas temperaturas, o hidrogênio molecular pode estar em equilíbrio com o hidrogênio atômico através da seguinte reação
H2 (g) ⇆ 2 H (g)
Sobre essa reação, são feitas as seguintes afirmações.
I - A quantidade de hidrogênio atômico aumenta com o aumento da temperatura, porque a reação é endotérmica.
II - Em condições de baixa temperatura, não há energia suficiente para romper a ligação.
III- A variação de entalpia envolvida na reação é o dobro da entalpia de formação do hidrogênio atômico nas condições da reação.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas I e III.
(D) Apenas II e III.
(E) I, II e III.
GABARITO. (E) I, II e III.
UFRGS 2020 - QUESTÃO 22
A reação do relógio de iodo é bastante comum em feiras de ciências e em demonstrações didáticas. Nela, a ocorrência de várias reações que envolvem iodo e compostos, contendo enxofre em diversos estados de oxidação, leva à formação de uma coloração azul súbita, dependente da concentração dos reagentes.
Uma possibilidade de realização dessa reação usa persulfato, tiossulfato e iodeto, e, nesse caso, uma das etapas é a reação entre o íon persulfato (S2O8²⁻) e o íon iodeto (I⁻), cuja velocidade de decomposição do persulfato foi determinada e encontra-se na tabela abaixo.
Assinale a alternativa que apresenta a velocidade inicial x do experimento 4, em mol L⁻¹ s⁻¹, tendo em vista as condições expressas acima.
(A) 0,512
(B) 2,048
(C) 2,560
(D) 6,400
(E) 8,120
GABARITO. (C) 2,560
UFRGS 2020 - QUESTÃO 23
A combustão incompleta de substâncias, contendo carbono, pode formar o monóxido de carbono, o qual é extremamente tóxico.
O monóxido de carbono, na presença de oxigênio, pode ser convertido no dióxido de carbono, em catalisadores automotivos, de acordo com a reação abaixo.
2 CO (g) + O2 (g) ⇆ 2 CO2 (g)
Em um determinado recipiente, contendo inicialmente monóxido de carbono e oxigênio, estabeleceu-se um equilíbrio em que se pode determinar a pressão total da mistura, 6,1 atm, e as pressões parciais de monóxido de carbono e de dióxido de carbono, as quais foram, respectivamente, 0,5 atm e 4,0 atm.
O valor da constante de equilíbrio será igual a
(A) 1,6.
(B) 10,6.
(C) 22,4.
(D) 32.
(E) 40.
GABARITO. (E) 40.
UFRGS 2020 - QUESTÃO 24
O ácido nitroso, HNO2, é um ácido fraco com KA = 4,3 x 10⁻⁴.
A respeito de uma solução aquosa de NaNO2, considere as seguintes afirmações.
I - É uma solução de pH menor que 7.
II - É mais alcalina do que uma solução aquosa de NaCl.
III- É mais ácida do que uma solução aquosa de NaOH de mesma concentração.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas I e III.
(D) Apenas II e III.
(E) I, II e III.
GABARITO. (D) Apenas II e III.
UFRGS 2020 - QUESTÃO 25
Baterias de Li – CO2 são de grande interesse atual, devido a questões ambientais e energéticas, pois utilizam CO2 e abrem um novo caminho para conversão e armazenamento de energia.
Uma das propostas sobre as semirreações eletroquímicas envolvidas nessa bateria é apresentada abaixo.
3CO2 (g) + 4Li⁺ + 4e⁻ → 2Li2CO3(s) + C (s) E° = 2,8V
2CO2 (g) + O2 (g)+ 4Li⁺ + 4e- → 2Li2CO3 (s) E° = - 3,8V
Sobre essas baterias, é correto afirmar que
(A) o cátion lítio é o agente oxidante; e o gás carbônico, o agente redutor.
(B) no funcionamento da bateria, 1 mol de CO2 é consumido gerando 1 mol de O2.
(C) no ânodo, ocorre formação de carbono elementar e carbonato de lítio.
(D) para recarregar a bateria, é necessário aplicar uma força eletromotriz de 3,8 V.
(E) o oxigênio sofre redução espontânea no cátodo.
GABARITO. (B) no funcionamento da bateria, 1 mol de CO2 é consumido gerando 1 mol de O2.