Exercício de Química (Questões EsPCEx 2020) com Gabarito QUÍMICA QUESTÃO 33 EsPCEx 2020 : Em química orgânica existem várias apresentações d...
Exercício de Química (Questões EsPCEx 2020) com Gabarito
QUÍMICA
QUESTÃO 33
EsPCEx 2020: Em química orgânica existem várias apresentações de fórmulas, como fórmulas moleculares e percentuais. A fórmula molecular indica o número de átomos de cada elemento em uma molécula da substância. A fórmula percentual indica a porcentagem, em massa, de cada elemento que constitui a substância. Uma maneira de determinação dessa fórmula é a partir da fórmula molecular, aplicando-se conceitos de massa atômica e massa molecular.
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 114
Tratando-se da estrutura e fórmula molecular, aldeídos são substâncias orgânicas que apresentam em sua estrutura o grupo carbonila ligado a um átomo de hidrogênio, na ponta de uma cadeia carbônica.
Considere os seguintes aldeídos: metanal; etanal; propanal; 3-metilbutanal e 2-metilbutanal.
Baseado nas fórmulas moleculares dos compostos citados, o aldeído que apresenta, em sua fórmula percentual, aproximadamente 54,5 % em massa de carbono (C) na sua estrutura é o
[A] metanal.
[B] etanal.
[C] propanal.
[D] 3-metilbutanal.
[E] 2-metilbutanal.
GABARITO. [B] etanal.
QUESTÃO 34
EsPCEx 2020: O oxalato de cálcio é oxidado por permanganato de potássio em meio ácido. A equação não balanceada dessa reação é representada a seguir:
CaC2O4 + KMnO4 + H2SO4 → CaSO4 + K2SO4 + MnO2 + 2O + CO2
A soma dos coeficientes da equação da reação corretamente balanceada (menores números inteiros) e o volume de CO2 liberado quando se faz reagir 384 g de oxalato de cálcio por reação
completa, na condição ambiente (25 ºC e 1 atm), são, respectivamente
Dados:
– volume molar nas condições ambiente de temperatura e pressão (25 ºC e 1 atm): 24,5 L · mol⁻¹; e
– constante universal dos gases R=0,082 L · atm · mol⁻¹ · K⁻¹.
[A] 25 e 168 L.
[B] 22 e 202 L.
[C] 25 e 147 L.
[D] 25 e 344 L.
[E] 22 e 98 L.
GABARITO. [C] 25 e 147 L.
QUESTÃO 35
EsPCEx 2020: O fósforo branco, de fórmula P4, é uma substância bastante tóxica. É utilizado para fins bélicos como arma química de guerra em granadas fumígenas. Pode ser obtido a partir do aquecimento do fosfato de cálcio, areia e coque em um forno especial, conforme mostrado na equação balanceada da reação:
2 Ca3(PO4)2 (s) + 6 SiO2 (s) + 10 C (s) → 6 CaSiO3 (s) + 1 P4 (s) + 10 CO (g)
A respeito da reação de obtenção do fósforo branco, seus participantes e suas características são feitas as seguintes afirmativas.
I – O fósforo branco é classificado como uma substância iônica polar.
II – O fósforo branco (P4) é classificado como uma substância simples.
III – A geometria da molécula do gás monóxido de carbono é angular.
IV – A massa de fósforo branco obtida quando se aquece 1860 g de fosfato de cálcio com rendimento de 80% é de 297,6 g.
V – A distribuição eletrônica do átomo de cálcio no estado fundamental é: 1s² 2s² 2p⁶ 3s² 3p⁵.
Das afirmativas feitas estão corretas apenas
[A] I, II, III e V.
[B] II e IV.
[C] II, IV e V.
[D] III e V.
[E] I, III e IV.
GABARITO. [B] II e IV.
QUESTÃO 36
EsPCEx 2020: O carbeto de cálcio, de fórmula CaC2, é muito comum em equipamentos usados por exploradores de cavernas para fins de iluminação. Ele reage com água e gera como um dos produtos o gás
acetileno (etino), de fórmula C2H2, conforme mostra a equação, não balanceada, a seguir
CaC2 (s) + H2O (l) → C2H2 (g) + Ca(OH)2 (s) (equação 1)
Sequencialmente, esse gás inflamável pode sofrer uma reação de combustão completa, liberando intensa energia, conforme a equação, não balanceada, a seguir
C2H2 (g) + O2 (g) CO2 → (g) + H2O (g) + calor (equação 2)
Uma massa de 512 g de carbeto de cálcio com pureza de 50% (e 50% de materiais inertes) é tratada com água, obtendo-se uma certa quantidade de gás acetileno. Esse gás produzido sofre uma reação de combustão completa.
Considerando a reação de combustão completa do acetileno nas condições ambientes (25ºC e 1 atm), o volume de gases obtidos e o valor da energia liberada como calor nessa reação, a partir da massa original de carbeto de cálcio, são, respectivamente,
Dados:
– volume molar na condição ambiente = 24,5 L · mol⁻¹ (25ºC e 1 atm); calor de combustão do etino = -1298 kJ · mol⁻¹; e
– constante universal dos gases R=0,082 L · atm · mol-1 · K⁻¹.
[A] 294 L e 3240 kJ.
[B] 156 L e 2320 kJ.
[C] 294 L e 4480 kJ.
[D] 156 L e 6660 kJ.
[E] 294 L e 5192 kJ.
GABARITO. [E] 294 L e 5192 kJ.
QUESTÃO 37
“Solução saturada: solução que contém a quantidade máxima de soluto em determinada quantidade de solvente, a determinada temperatura; a relação entre quantidades máximas de soluto e quantidade de solvente é denominada de coeficiente de solubilidade”.
“Solução insaturada: quando a solução contém uma quantidade de soluto inferior ao seu coeficiente de solubilidade, na temperatura em que se encontra a solução”.
“Solução supersaturada: quando a solução contém uma quantidade de soluto dissolvido superior ao seu coeficiente de solubilidade, na temperatura em que se ela se encontra. É instável”
USBERCO, João e SALVADOR, Edgard, Físico-química, São Paulo, Ed Saraiva, 2009, Pág. 18.
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 18 e 19.
EsPCEx 2020: Considere o gráfico da curva de solubilidade em função da temperatura para um sal hipotético A. No gráfico, a linha contínua representa a solubilidade máxima do soluto (sal A) em 100 g de água na temperatura correspondente.
Acerca desse gráfico e processo de solubilidade são feitas as seguintes afirmativas:
I – Na temperatura de 20 ºC, misturando-se 50 g do sal A em 100 g de água, ter-se-á um sistema heterogêneo.
II – Na temperatura de 40 ºC, a adição de 50 g do sal A em 100 g de água produzirá uma solução insaturada.
III – 200 g de água dissolvem totalmente 90 g do sal A a 30 ºC.
IV – Uma solução contendo 60 g do sal A em 100 g de água será saturada em 60 ºC.
Das afirmativas feitas estão corretas apenas
[A] I,II e IV.
[B] II e III.
[C] I e IV.
[D] III e IV.
[E] I, II e III.
GABARITO. [E] I, II e III.
QUESTÃO 38
“No fenômeno físico, a composição da matéria é preservada, ou seja, permanece a mesma antes e depois da ocorrência do fenômeno”.
“Reação química é toda transformação que modifica a natureza da matéria (fenômenos químicos)”.
“No fenômeno químico, a composição da matéria é alterada: sua composição antes de ocorrer o fenômeno é diferente da que resulta no final”.
FONSECA, Martha Reis Marques da, Química Geral,
São Paulo, Ed FTD, 2007, Pág. 24 e 61.
EsPCEx 2020: Considere os conceitos supracitados e as transformações representadas pelas equações químicas a seguir:
I – CaCO3 (s) → CaO (s) + CO2 (g)
II – H2O (l) → H2O (g)
III – H2 (g) + O2 (g) → H2O (g)
IV – C(grafite) + O2 (g) → CO2 (g)
Correspondem a reações químicas apenas as transformações
[A] I e III.
[B] II e IV..
[C] II, III e IV.
[D] I, III e IV.
[E] I, II e III.
GABARITO. [D] I, III e IV.
QUESTÃO 39
EsPCEx 2020: Gases apresentam um fenômeno chamado de difusão de gases.
“Difusão gasosa é o movimento espontâneo das partículas de um gás de se espalharem uniformemente em meio das partículas de um outro gás ou de atravessarem uma parede porosa. Quando gases diferentes (A e B) estão a uma mesma temperatura, para uma quantidade de matéria igual a 1 mol de gás A e 1 mol de gás B, tem-se que a massa do gás A (ma) será igual à massa molar do gás A (Ma), e a massa do gás B (mb) será igual à massa molar do gás B (Mb).”
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 110.
Considere que, em determinadas condições de temperatura e pressão, a velocidade de difusão de 1 mol do gás hidrogênio (H2) seja de 28 km/min. Nestas mesmas condições a velocidade (em km/h) de 1 mol do gás metano (CH4) é de
Dado:
√2 = 1,4
[A] 600 km/h.
[B] 729 km/h.
[C] 1211 km/h.
[D] 422 km/h.
[E] 785 km/h.
GABARITO. [A] 600 km/h.
QUESTÃO 40
EsPCEx 2020: Em épocas distintas, os cientistas Dalton, Rutherford e Bohr propuseram, cada um, seus modelos atômicos. Algumas características desses modelos são apresentadas na tabela a seguir:
A alternativa que apresenta a correta correlação entre o cientista proponente e o modelo atômico por ele proposto é
[A] Rutherford - Modelo II; Bohr - Modelo I e Dalton - Modelo III.
[B] Rutherford - Modelo III; Bohr - Modelo II e Dalton - Modelo I.
[C] Rutherford - Modelo I; Bohr - Modelo II e Dalton - Modelo III.
[D] Rutherford - Modelo I; Bohr - Modelo III e Dalton - Modelo II.
[E] Rutherford - Modelo III; Bohr - Modelo I e Dalton - Modelo II.
GABARITO. [D] Rutherford - Modelo I; Bohr - Modelo III e Dalton - Modelo II.
QUESTÃO 41
EsPCEx 2020: O ácido etanoico, também denominado usualmente de ácido acético, é um ácido orgânico e uma das substâncias componentes do vinagre. Considerando-se a substância ácido etanoico, pode-se afirmar que:
I – É um composto cuja fórmula molecular é C2H6O.
II – Possui apenas ligações covalentes polares entre seus átomos.
III – Possui um carbono com hibridização sp¹.
IV – Possui dois carbonos assimétricos (quiral).
V – O anidrido etanoico (acético) é isômero de cadeia do ácido etanoico (acético).
VI – Pode ser obtido pela oxidação enérgica do but-2-eno em presença do permanganato de potássio e ácido concentrado.
VII – Em condições adequadas, sua reação com sódio metálico produz etanoato de sódio e libera H2.
Das afirmativas feitas, estão corretas apenas
[A] III, VI e VII.
[B] I, II, IV e V.
[C] II, IV e VII.
[D] I, III, V e VI.
[E] III, IV, V, VI e VII.
GABARITO. [A] III, VI e VII.
QUESTÃO 42
EsPCEx 2020: Diagramas de fases são gráficos construídos para indicar uma condição de temperatura e pressão de uma substância e suas mudanças de estado. Cada uma das curvas do diagrama indica as condições de temperatura e pressão nas quais as duas fases de estado estão em equilíbrio.
Modificado de USBERCO, João e SALVADOR, Edgard, Físico-química,
São Paulo, Ed Saraiva, 2009, Pág. 98
Considere o diagrama de fases da água, representado na figura abaixo:
Baseado no diagrama e nos processos químicos envolvidos são feitas as seguintes afirmativas:
I – A temperatura de fusão da água aumenta com o aumento da pressão.
II – Na temperatura de 100 ºC e 218 atm a água é líquida.
III – A água sólida (gelo) sublima a uma pressão de vapor superior a 1 atm.
IV – Na temperatura de 0 ºC e pressão de 0,006 atm, a água encontra-se na fase sólida.
Das afirmativas feitas, estão corretas apenas
[A] I, II e IV.
[B] I e II.
[C] II e IV.
[D] II e III.
[E] III e IV.
GABARITO. [C] II e IV.
QUESTÃO 43
EsPCEx 2020: Ao emitir uma partícula Alfa (α), o isótopo radioativo de um elemento transforma-se em outro elemento químico com número atômico e número de massa menores.
A emissão de uma partícula beta (β) por um isótopo radioativo de um elemento transforma-o em outro elemento de mesmo número de massa e número atômico uma unidade maior.
Baseado nessas informações são feitas as seguintes afirmativas:
I – Na desintegração  → partícula +
→ partícula +  ocorre com a emissão de uma partícula β.
ocorre com a emissão de uma partícula β.
 → partícula +
→ partícula +  ocorre com a emissão de uma partícula β.
ocorre com a emissão de uma partícula β.II – Na desintegração  → partícula +
→ partícula + 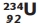 ocorre com a emissão de uma partícula β.
ocorre com a emissão de uma partícula β.
 → partícula +
→ partícula + 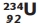 ocorre com a emissão de uma partícula β.
ocorre com a emissão de uma partícula β.IV – Uma partícula beta (β) tem carga negativa e massa comparável a do próton.
V – O urânio-238 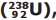 pode naturalmente sofrer um decaimento radioativo emitindo sequencialmente 3 partículas alfa e 2 beta, convertendo-se em rádio
pode naturalmente sofrer um decaimento radioativo emitindo sequencialmente 3 partículas alfa e 2 beta, convertendo-se em rádio  .
.
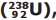 pode naturalmente sofrer um decaimento radioativo emitindo sequencialmente 3 partículas alfa e 2 beta, convertendo-se em rádio
pode naturalmente sofrer um decaimento radioativo emitindo sequencialmente 3 partículas alfa e 2 beta, convertendo-se em rádio  .
.Das afirmativas feitas, estão corretas apenas
[A] I, II e IV.
[B] I e V.
[C] II e III.
[D] II e V.
[E] III, IV e V.
GABARITO. [D] II e V.
QUESTÃO 44
EsPCEx 2020: Nestes últimos anos, os alunos da EsPCEx têm realizado uma prática no laboratório de química envolvendo eletrólise com eletrodos inertes de grafite. Eles seguem um procedimento experimental conforme a descrição:
- Num béquer de capacidade 100 mL (cuba eletrolítica) coloque cerca de 50 mL de solução aquosa de sulfato de zinco (ZnSO4) de concentração 1 mol·L⁻¹. Tome como eletrodos duas barras finas de grafite. Ligue-as com auxílio de fios a uma fonte externa de eletricidade (bateria) com corrente de 2 Ampères.
Esta fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. Uma das barras deve ser ligada ao polo negativo da fonte e a outra barra ao polo positivo da fonte. Mergulhe os eletrodos na solução durante 32 minutos e 10 segundos e observe.
Considere o arranjo eletrolítico (a 25 ºC e 1 atm), conforme visto na figura a seguir:
Dados:
1 Faraday (F) = 96500 Coulomb (C) / mol de elétrons
Acerca do experimento e os conceitos químicos envolvidos são feitas as seguintes afirmativas:
I – Na superfície da barra de grafite ligada como cátodo da eletrólise ocorre a eletrodeposição do zinco metálico.
II – A semirreação de oxidação que ocorre no ânodo da eletrólise é Zn (s) Zn²⁺ (aq) + 2 e⁻.
III – Durante o processo a barra de grafite ligada ao polo positivo da bateria se oxida.
IV – No ânodo da eletrólise ocorre uma reação de oxidação da hidroxila com formação do gás oxigênio e água.
V – A massa de zinco metálico obtida no processo de eletrólise será de 0,83 g.
Das afirmativas feitas, estão corretas apenas
[A] I e IV.
[B] I, III e IV.
[C] I e V.
[D] II e III.
[E] III, IV e V.
GABARITO. [A] I e IV.





